Hydrofilní interakční chromatografie – HILIC
Chromatografie HILIC byla používána již dávno, ale její jméno bylo vytvořeno teprve nedávno. Dříve byla tato technika spojována společně s jinými chromatografickými technikami a často byl ignorován separační mechanismus. HILIC může být chápána jako rozšířená chromatografie na normální fázi s vodnými mobilními fázemi.[1] HILIC je separační technika vhodná pro polární a hydrofilní látky.
Obsah
Retenční mechanismus
Ovlivnění retence v HILIC je velmi podobné jako při normální fázi. Retence se zvyšuje s polaritou solu-tu a snižuje se zvýšením polarity mobilní fáze (klesá s rostoucím podílem vody nebo pufru). Mobilní fáze je naopak obdobná mobilním fázím používaných v reverzní chromatografii a používá se voda nebo pufr s organickým rozpouštědlem. Stacionární fáze je velmi hydrofilní: silikagel, polární vázané fáze, polární poly-merní fáze a iontoměniče. Hydrofilnější stacionární fáze více poutá vodu z mobilní fáze a retence solutu se zvyšuje. Následkem toho, retenční mechanismus se může vysvětlit jako rozdělování solutu mezi na vodu bohatší stacionární fází a na vodu chudší mobilní fází. Stacionární fáze se tak chová jako „přenašeč“ vody, ale tento mechanismus má i své výjimky, které nejsou dostatečně prostudované. V případě separace sacharidů chromatografií HILIC, kdy se použijí chemicky vázané různé aminové fáze, dochází k různé retenci v závislosti na použi-tém chemicky vázaném ligandu.
Obr. 1 Vliv obsahu methanolu (prázdné body) resp. acetonitrilu (tmavé body) na retenci adeninu (£) a cytosinu (D)
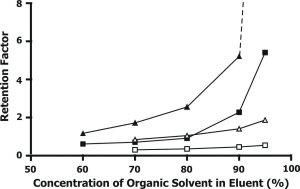
|
Jako druhý mechanismus, který se uplatňuje, je mechanismus iontové výměny, neboť mnohé stacionár-ní fáze mají vlastnosti iontoměniče. Tento mechanismus může být s úspěchem použit při ovlivnění selektivity separace. K ovlivnění retence se používá také přídavek pufrů do mobilní fáze. Retence klesá se zvyšující se kon-centrací solí. Vliv pH závisí na vlastnostech solutu; v případě že dochází k disociaci solutu retence se zvyšuje oproti neutrálním solutům.
Stacionární fáze a kolony pro HILIC
Jako stacionární fáze se používá chemicky vázaný aminopropyl na silikagelu. Nevýhodou chemicky modifikovaného silikagelu je, že aminové skupiny vázané na silikagel dávají vznikat alkalickému prostředí v pórech silikagelu (koncentrace se pohybuje okolo 1 mol/l). Výsledné alkalické pH v pórech je příčinou, že dochází k pomalému rozpouštění silikagelu a hydrolýze chemicky vázané fáze. Jako alternativa se používá silikagel dynamicky pokrytý polyaminy (triethylentetramin nebo spermidin) nebo zesítněném polyaminy chemicky vázané na silikagel (polyvinylalkohol derivatizovaní polyaminy), které jsou hydrolyticky stabilnější. Jako další stacionární fáze se používá samotný silikagel kde volné silanolové skupiny hrají roli středního iontoměniče. Mezi další stacionární fáze HILIC patří chemicky vázané fáze na silikagel jako je diol (glycidylpropyl) nebo acetamidopropylová fáze. K použitelným fázím pro HILIC je možné také zařadit neutrální hydrofilní polymerové fáze.[2] Jsou to zejména hydrofilní methakrylátové fáze používané v GPC. Povrch těchto stacionárních fází obsahuje polyolové skupiny, které jsou velmi hydrofilní.
Mobilní fáze
Teoreticky je možné použít jako mobilní fáze všechny vodno-organické fáze, ale preferuje se především acetonitril, který má malou viskozitu a tím dostáváme vysokou účinnost separace a nízký tlak na chromatogra-fické koloně. Obvyklá koncentrace acetonitril se pohybuje v rozmezí od 50 do 90 %, pro separaci sacharidů například je obsah acetonitril 70 % jako optimální. Může se také použít isopropanol, ale mobilní fáze mají vyšší viskozitu.
V případě, že se uplatňuje na koloně mechanismus iontové výměny, pak se k ovlivnění retence použí-vají pufrované mobilní fáze. Se zvýšením koncentrace soli klesá retence, ale stoupá doba ekvilibrace kolony. Jako soli se používají organické aminy (triethylamin). Pro malé molekuly roste retence asi o 10 % se změnou o každé 1 % organického rozpouštědla. Koncentrace solí se pohybuje od 5 do 15 mM, se stoupajícím obsahem organického modifikátoru může docházet ke srážení těchto solí ze systému a proto by se jejich koncentrace měla snižovat. Jako vhodné k použití se jeví chloristany, fosforečnany triethylaminu (koncentrace až 100 mM v 80 % acetonitrilu ) a sodné soli kyseliny methylfosforečné.
Aplikace
Klasickým příkladem separace technikou HILIC je separace sacharidů, aminokyselin, peptidů a polár-ních organických kyselin a zásad. Při separaci sacharidů se používá aminopropylová fáze jako stacionární a mobilní fáze acetonitril-voda (70+30) ve spojení s refraktometrickým detektorem, UV detektorem při UV < 200 nm nebo ELSD detektorem. V případě UV de-tekce je možné použít i gradientové eluce.
Další související odkazy:
Literatura
[1] Albert A.J.: J. Chromatos. 499, 177 (1990).
[2] Bendiak B., Orr J., Brockhausen I., Vella G., Phoebe C.: Anal. Biochem. 175, 96 (1988).
Last modified:

