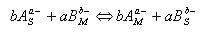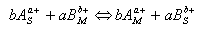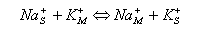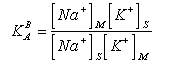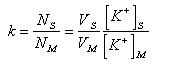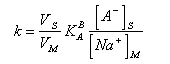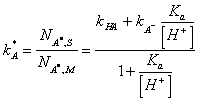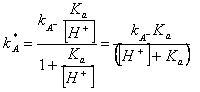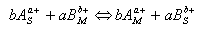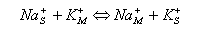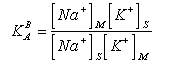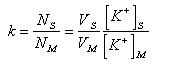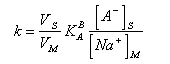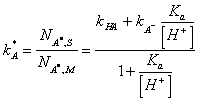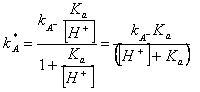Iontová chromatografie
Mechanismus separace
Chromatografie na měničích iontů je založena na silných elektrostatických silách mezi ionizovanými funkčními skupinami měniče a ionty v okolním roztoku. Pro výměnu iontů poutaných funkčními skupinami měniče (stacionární fáze) za ionty v roztoku mobilní fáze můžeme napsat rovnici iontové výměny:
a) pro anionty
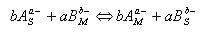
|
b) pro kationty
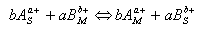
|
kde symboly S, M značí stacionární a mobilní fázi. Při dělení látek na iontoměničích se využívá jejich různé selektivity sorpce k měniči. Tato selektivita je popsána selektivním koeficientem KAB což je vlastně rovnovážná konstanta iontové výměny.
Nechť máme iontovou výměnu reprezentovanou Na+ ionty mobilní fáze a K+ ionty jako ionty analytu. Pak pro iontovou výměnu a selektivní koeficient můžeme napsat:
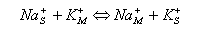
|
Pro koeficient selektivity KAB platí:
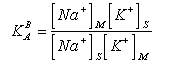
|
Pro kapacitní poměr můžeme napsat:
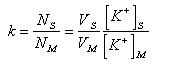
|
kde NS, NM jsou počty molekul ve stacionární resp. mobilní fázi. Úpravou dostaneme výraz:
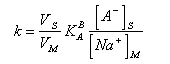
|
kde [A-]S je koncentrace vázaných iontovýměnných skupin a můžeme napsat že [A-]S = [Na+]S. Koncentrace vázaných iontovýměnných skupin [A-]S se nazývá výměnná kapacita měniče a označuje se Q.
kde [A-]S je koncentrace vázaných iontovýměnných skupin a můžeme napsat že [A-]S = [Na+]S. Koncentrace vázaných iontovýměnných skupin [A-]S se nazývá výměnná kapacita měniče a označuje se Q.
Z výrazu pro kapacitní poměr je zřejmé, že s rostoucí koncentrací iontů Na+ v mobilní fázi se snižuje kapacitní poměr chromatografovaných látek, přičemž logaritmické závislosti kapacitních poměrů log k na log [Na+] jsou lineární a směrnice je určena nábojem chromatografovaných iontů.
Vliv pH mobilní fáze
Na velikost kapacitních poměrů má vliv i pH a iontová síla mobilní fáze, což se projevuje především u silně polárních látek. Vliv pH je velmi složitý, zejména u vícesytných kyselin či bází. Nechť máme jednosytnou kyselinu HA, která je separována na silném iontoměniči, pro kapacitní poměr můžeme napsat:
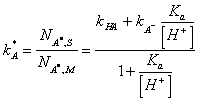
|
Z rovnice je zřejmé, největší vliv pH je v okolí pH = pK dané kyseliny či báze, kdy sebemenší změna pH má vliv na disociaci těchto látek. Rovnice se dá přepsat do tvaru, kdy zavedeme opodstatněnou aproximaci kHA = 0:
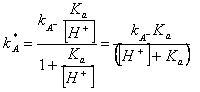
|
Z tohoto výrazu je evidentní, že pro daný případ (kyselina HA), se stoupající koncentrací vodíkových iontů (klesající pH) se kapacitní poměry snižují.
Last modified: