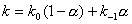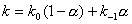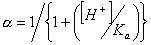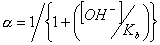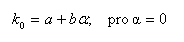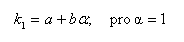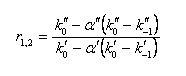Vliv pH mobilní fáze na retenci solutů
Silně polární a iontové látky na nepolárních fázích se zadržují velmi málo nebo vůbec ne a eluují v mrtvém objemu kolony nebo dříve, než odpovídá mrtvému objemu kolony - což je jev tzv. iontové výluky. Pro látky iontové povahy proto můžeme jejich chromatografické chování ovlivnit volbou pH mobilní fáze, kdy změnou pH mobilní fáze dochází k potlačení disociace slabých kyselin (pH < 7) či slabých bází (pH > 7). Potlačením disociace (
obrázek) dochází ke zvýšení retence a zamezení chvostování píku dané chromatografované látky. Pro organické kyseliny dochází k potlačení disociace snížením pH na hodnotu asi pH 2-5, pro organické báze dochází k potlačení disociace zvýšením pH na hodnotu asi pH 7-8, ale toto pH je omezeno rozpouštěním silikagelu při pH > 8,5. Selektivita pro karboxylové kyseliny na reverzní fázi je závislá na použité mobilní fázi (její pH) a na použité reverzní fázi. V reverzních stacionárních fázích závisí retence jednosytné kyseliny HA na pH a na disociační konstantě karboxylové kyseliny Ka:
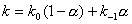
|
kde
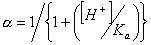
|
k0 a k-1jsou retenční faktory neionizované a ionizované formy a a je stupeň disociace (frakce ionizovaných molekul). Obdobně pro selektivitu bazí na reverzní fázi platí stejná rovnice kde
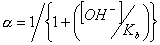
|
Zvýšení retence a zlepšení symetrie píků ionizovaných látek se může dosáhnout přídavkem neutrálních solí do mobilní fáze - tzv. vysolovací efekt.[1]
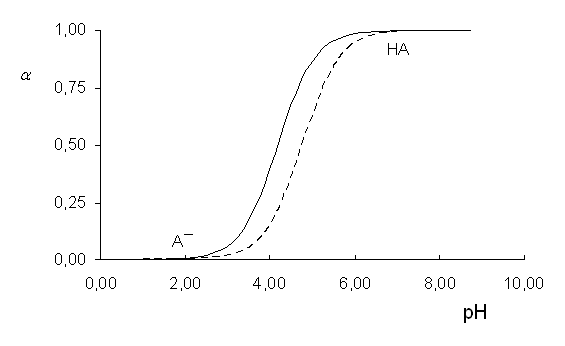
Závislost stupně disociace na pH
(kyselina sorbová (___) pKa = 4,76 a benzoová (---) pKa = 4,19)
|
|
V případě, že se získá lineární závislost kapacitního poměru k na stupni disociace a (v lineární oblasti závislosti stupně disociace a na pH solutu) pak pro k0 a k-1 platí:
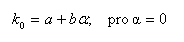
|
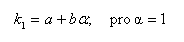
|
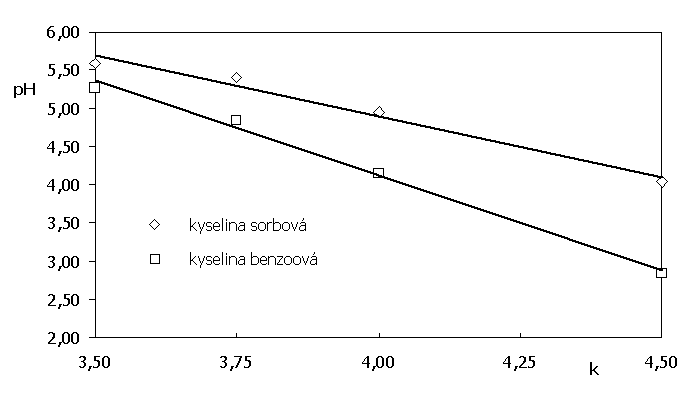
Určením koeficientů k0 a k-1 je možné predikovat chování solutů při změně pH mobilní fáze. Jestliže platí k-1 ≠ k-1 pak změnou pH můžeme ovlivnit sepraci solutů (selektivitu systému). Experimentální hodnoty kapacitních poměrů kyseliny benzoové a sorbové při separaci na reverzní fázi C18 získané při různém pH mobilní fáze (pH 3,5 - 4,5) jsou zpracovány graficky:
|
Ze získaných experimentálních dat byly vypočteny kapacitní faktory k0 a k-1 pro kyselinu benzovou (k0 = 6,10; k-1 = 1,23) i sorbovou (k0 = 5,81; k-1 = 0,73). Při pH 4,5 je selektivita systému nejvyšší a kapacitní poměr získaný experimentálně pro kyselinu benzoovou je 2,84 (výpočtem pak 2,83), kapacitní poměr získaný experimentálně pro kyselinu benzoovou je 4,04 (výpočtem pak 4,01). Experimentální a vypočtená data jsou tak ve výborné shodě.
Pro eluční poměr (selektivitu) r2,1 můžeme odvodit rovnici:
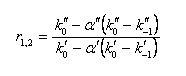
|
kde index ´´ značí kyselinu sorbovou a index ´ se vztahuje ke kyselině benzoové. Na základě této rovnice byl vypočten eluční poměr r2,1 (teor) = 1,42 což odpovídá experimentálně získanému elučnímu poměru r2,1 (exp) = 1,42.
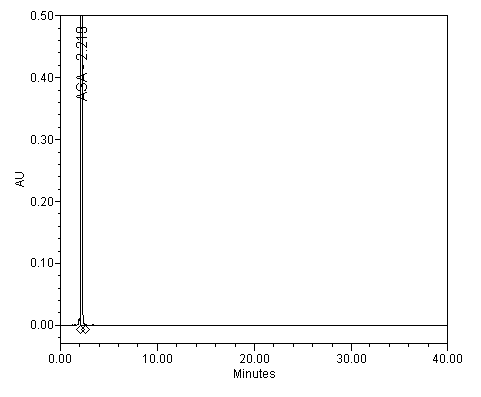
Jako příklad vlivu pH na separaci kyseliny salicylové (SA; pKa=2,98) a acetysalicylové (ASA; pKa=3,50) je ukázán na následujících obrázcích.
Separace kyseliny salicylové a acetylsalicylové; pH 6.2
|
Separace kyseliny salicylové a acetylsalicylové; pH 3.8
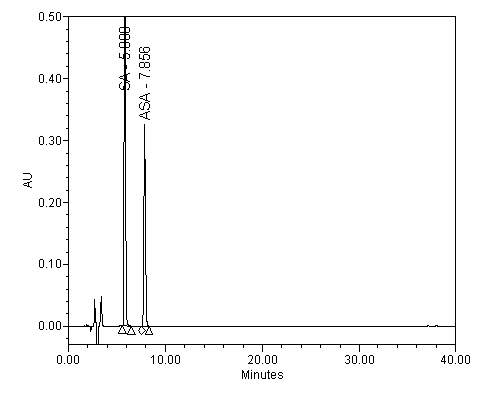
|
Separace kyseliny salicylové a acetylsalicylové; pH 1.8
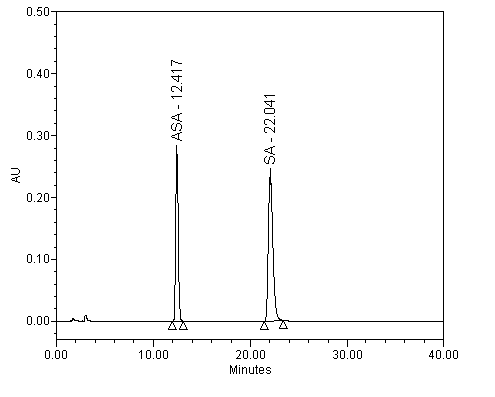
|
Související odkazy
Literatura
[1]. Jandera P., Churáček J., Bartošová J.: Chromatographia 13, 485 (1980).
Last modified: