Problémy přenosu HPLC metod a jejich vhodné korekce
Při přenosu publikované HPLC metody na jiné pracoviště nebo z jedné instrumentzace na druhou nastávají mnohdy problémy s interpretací separace sledovaných analytů a nastává problém vůbec reprodukovat publikovanou metodu. Typický příklad přenosu HPLC metody je ukázán na obrázku č.1.
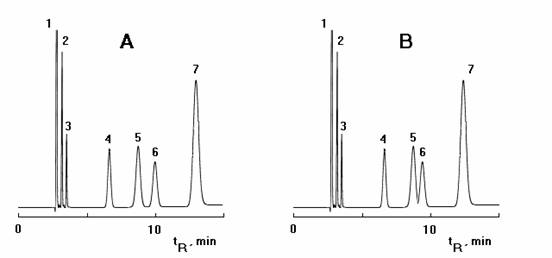
|
Obr. 1 Přenos HPLC metody z jedné instrumentace na druhou. A – původní instrumentace, B – cílová instrumentace
Z obr. 1 je zřejmé, že nedochází k separaci analytů 5,6 a rozlišení RS < 1,5. Existuje několik příčin proč nedochází k dokonalé separaci:
Nedostatečnou ekvilibraci chromatografické kolony jako hrubou chybu vyloučíme a dále budeme rozebírat pouze poslední tři možné
příčiny.
1. Změna chromatografické kolony
Změnou kolony (jiný výrobce, jiná šarže) zpravidla dojde ke změně:
- účinnosti kolony (počet teoretických pater, n)
- selektivity (retenční poměr, r12)
Proto je vhodné při validaci metody určit chromatografické parametry kolony, které vyhovují pro danou chromatografickou separaci:
- účinnost kolony
- selektivitu
- silanolovou aktivitu
Jako výhodné se jeví Tanakovy testy chromatografických charakteristik stacionární fáze:
kapacita kolony (účinnost) – kpentylbenzenu, npentylbenzenu
hydrofobicita 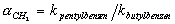 silanolová aktivita
silanolová aktivita 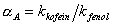
a poté validovat metodu nejen na zvolené chromatografické koloně ale i určit vhodnou alternativní chromatografickou variantu. Používá se
tzv. metoda maximální chromatografické variability, která zahrnuje:
1.1 Optimalizace chromatografických podmínek
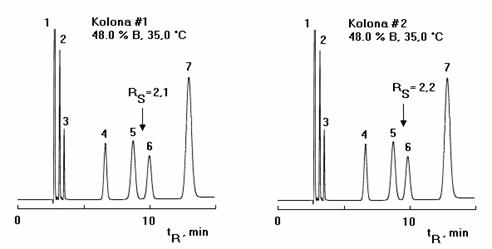
Chromatografické podmínky se optimalizují tak, že se sleduje vliv teploty a složení mobilní fáze (% organické fáze nebo strmost gradientu) na RS nebo r12 a vícenásobnou regresí se získá RS mapa
akceptovatelných rozlišení při daných chromatografických podmínkách. Pak při změně rozlišení RS můžeme velmi jednoduše určit chromatografické podmínky, které budou vyhovovat požadovanému rozlišení. Praktický příklad je patrný z obrázku č.2.
1.2 Variabilita chromatografických kolon
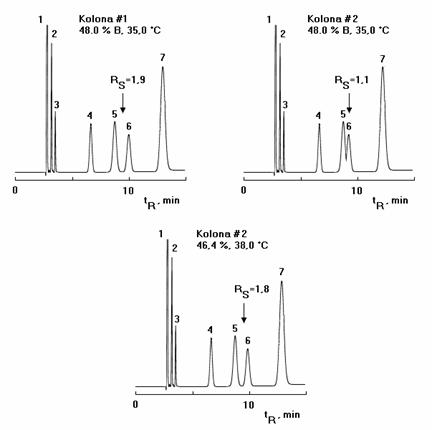
Obdobně jako u optimalizace chromatografických podmínek se optimalizují chromatografické kolony pro alternativní kolony a pak dostáváme nejen chromatografické podmínky pro používanou kolonu, ale i pro alternativní chromatografickou kolonu. Určením tzv. RS map a jejich překryvem pro dvě různé kolony získáme ihned přehled, jak bude vypadat separace na alternativní koloně. Praktický příklad je patrný z obrázku č.3.
Obr. 2 Optimalizace chromatografických podmínek a aplikace na dvě stejné kolony různé šarže
|
Obr. 3 Variabilita chromatografických kolon a určení RS map
|
1.3 Výběr podobných kolon
K celkové selektivitě stacionární fáze přispívají jednak kapacitní faktor k;a dále hydrofobicita (H), stérická selektivita (shape selektivity; S), silanolová aktivita (non-ionized silanol acidity nebo také silanol group capacity, A), kolonová basicita (column basicity; B) a iontově-výměnná kapacita (cation-exchange capacity; C). Pro logaritmus kapacitního faktoru pak platí:
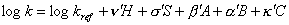
|
kde k, a, b,s a n jsou příspěvky solutu a H, S, A, B a C jsou příspěvky stacionární fáze a kref je kapacitní faktor daný distribuční konstantou a fázovým poměrem. Příspěvek hydrofobicity H souvisí s nespecifickými interakcemi solutu se stacionární fází (methylenová selektivita aCH2, příspěvky silanolové aktivity A a kolonové basicity B souvisí s možností tvorby vodíkových vazeb mezi solutem a zbytkovými silanolovými skupinami silikagelu. Určením selektivity různých chromatografických kolon (Tanakovy a Engelhardtovy testy)[1], [2], [3] tak můžeme získat přehled o podobných kolonách, které je možné použít pak jako alternativní kolony ke koloně používané (validované). Porovnání selektivity stacionárních fází podle Tanakových testů je ukázáno na obrázku:

|
2. Změna HPLC systému nebo HPLC procedury
Změna HPLC systému vede ve většině případech ke změnám:
- mrtvého objemu systému (při gradientu mobilní fáze)
- změna mimokolonových příspěvků k rozšíření chromatografické zóny
2.1 Mrtvý objem systému
Změna mrtvého objemu systému (konstrukce pumpy, změna vnitřního průměru kapilár) vede ke změně mrtvého objemu systému, která může mít
vliv na strmost gradientu (zpoždění gradientu, které má vliv na separaci kritických analytů). Na separaci má vliv i tvorba gradientu – změna tvorby gradientu z nízkotlakého gradientu na vysokotlaký vede ke zpoždění gradientu a to má pak vliv na separaci kritických analytů.
2.2 Mimokolonové příspěvky
Mimokolonové příspěvky k rozšíření chromatografické zóny mají vliv na účinnost systému a změna objemu nástřiku, objemu cely
detektoru, vnitřního průměru kapilár nebo jejich délky, může mít vliv na účinnost kolony a to vede ke snížení rozlišení kritických analytů.
3. Změna v chromatografickém postupu
Ke změně v chromatografickém postupu (metody) může dojít:
- ve změně složení mobilní fáze (změna objemové frakce organického rozpouštědla, pH, koncentrace aditiv [pufry, iontové páry])
- změnou teploty na chromatografické koloně
- změnou gradientu (použití jiného tvorby gradientu, přechod z vysokotlakého gradientu na nízkotlaký a naopak)
Související odkazy:
Transfer metody HPLC/UPLC
Mrtvý objem chromatografické kolony HPLC a mrtvý objem systému
Mimokolonové příspěvky k rozšíření chromatografické zóny
Optimalizace chromatografických podmínek
HPLC Column Classification
Literatura
[1] Ohtsu Y., Shioshima Y., Okumura T., Koyama J.-I., Nakamura O., Kimata K., Tanaka N.: J. Chromatogr. 481, 147 (1989).
[2] Engelhardt H., Arangio M., Lobert T.: LC-GC Int., 12 (1997).
[3] Engelhardt H.: Chromatographia 29, 59, (1990).
Last modified:




![]()
